Postingan ini membahas contoh soal laju reaksi dan penyelesaiannya atau pembahasannya. Lalu apa itu laju reaksi ?. Laju reaksi diartikan sebagai laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu. Satuan jumlah zat bermacam-macam misalnya gram, mol atau konsentrasi. Sedangkan satuan waktu yang digunakan adalah detik, menit, jam, hari ataupun tahun. Dalam reaksi kimia banyak digunakan zat kimia yang berupa larutan atau berupa gas dalam keadaan tertutup, sehingga dalam laju reaksi digunakan satuan konsentrasi atau molaritas.
Pada awal reaksi, reaktan ada dalam keadaan maksimal sedangkan produk ada dalam keadaan minimal. Setelah reaksi berlangsung, maka produk mulai terbentuk. Semakin lama produk akan semakin banyak terbentuk, sedangkan reaktan semakin lama semakin berkurang. Rumus dan grafik laju reaksi digambarkan seperti dibawah ini.
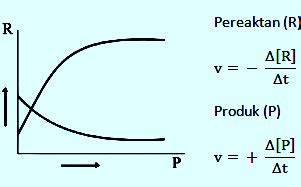
Keterangan:
- v = laju reaksi (M/s)
- Δ[R] = perubahan konsentrasi reaktan (M)
- Δ[P] = perubahan konsentrasi produk
- Δt = perubahan waktu
Persamaan laju reaksi
Secara umum, pada reaksi xA + yB → zC maka persamaan laju reaksi ditulis v = k [A]m [B]n. Keterangan:
- v = laju reaksi (M/s)
- k = tetapan laju reaksi
- [A] = konsentrasi awal A (M)
- [B] = konsentrasi awal B (M)
- m = orde A
- n = orde B
Laju reaksi dipengaruhi oleh faktor-faktor dibawah ini.
- Konsentrasi, semakin tinggi konsentrasi suatu larutan maka makin besar laju reaksinya.
- Luas permukaan, semakin besar luas permukaan maka laju reaksinya semakin cepat.
- Suhu, kenaikan suhu akan memperbesar laju reaksi
- Katalisator, adalah zat yang dapat memperbesar laju reaksi tetapi tidak mengalami perubahan kimia secara permanen.
Contoh soal laju reaksi
Contoh soal 1 (UN 2019)
Pada penentuan laju reaksi H2 (g) + O2 (g) → 2H2O (l) diperoleh data percobaan sebagai berikut:
| [H2] M | [O2] M | Laju reaksi (v) |
|---|---|---|
| 0,1 | 0,2 | 4 M/s |
| 0,1 | 0,4 | 4 M/s |
| 0,2 | 0,2 | 16 M/s |
Orde reaksi total dari reaksi tersebut adalah…
A. 0
B. 1/2
C. 1
D. 2
E. 3
Penyelesaian soal / pembahasan
Cara menjawab soal ini kita tentukan terlebih dahulu orde reaksi H2 dengan cara mengambil data konsentrasi O2 yang sama, yaitu percobaan 1 dan 3.
→→
→
→ m = 2
Selanjutnya kita hitung orde reaksi O2 dengan cara mengambil data konsentrasi H2 yang sama yaitu percobaan 1 dan 2.
→→
→
→ n = 1
Jadi orde reaksi percobaan diatas adalah m + n = 2 + 1 = 3. Soal ini jawabannya E.
Contoh soal 2 (UN 2016)
Pengamatan laju reaksi NO (g) + Cl2 (g) → NOCl2 (g) disajikan dalam tabel berikut:
| [NO] (M) | [Cl2] (M) | Laju reaksi |
|---|---|---|
| 0,2 | 0,1 | 0,24 M/s |
| 0,2 | 0,2 | 0,48 M/s |
| 0,4 | 0,2 | 1,92 M/s |
Rumus persamaan laju reaksi yang benar adalah…
A. v = k [NO]2 [Cl2]
B. v = k [NO] [Cl2]
C. v = k [NO] [Cl2]2
D. v = k [NO]2 [Cl2]2
E. v = k [Cl2]
Penyelesaian soal / pembahasan
Untuk menjawab soal ini tentukan terlebih dahulu orde reaksi NO dengan cara mengambil data konsentrasi Cl2 yang sama yaitu percobaan 2 dan 3.
→→
→
→ m = 1
Selanjutnya kita hitung orde reaksi Cl2 dengan mengambil konsentrasi NO yang sama yaitu percobaan 1 dan 2.
→→
→
→ n = 1
Jadi persamaan laju reaksi yang benar adalah v = k [NO] [Cl2]. Soal ini jawabannya B.
Contoh soal 3
Untuk reaksi A (g) + B (g) → AB (g) diperoleh data sebagai berikut:
| [A] (M) | [B] (M) | v (M/s) |
|---|---|---|
| 0,05 | 0,4 | 2 |
| 0,20 | 0,4 | 8 |
| 0,20 | 0,8 | 16 |
Tetapan laju reaksi percobaan diatas adalah…
A. 4
B. 20
C. 40
D. 80
E. 100
Penyelesaian soal / pembahasan
Kita hitung terlebih dahulu orde [A] dengan cara dibawah ini:
→→
→
→ m = 1
Selanjutnya kita hitung orde [B] dengan cara dibawah ini:
→→
→
→ n = 1
Jadi persamaan laju reaksi v = k [A]. Untuk menghitung k, kita ambil data yang pertama sehingga diperoleh hasil seperti dibawah ini:
→ k =→ k =
Soal ini jawabannya E.
Contoh soal 4
Suatu reaksi akan berlangsung 2 kali lebih cepat dari semula jika suhu dinaikkan 20°C. Jika pada suhu 30 °C reaksi berlangsung selama 4 menit, maka pada suhu 70 °C reaksi akan berlangsung selama…
A. 0,5 menit
B. 1 menit
C. 2 menit
D. 8 menit
E. 12 menit
Penyelesaian soal / pembahasan
Pada soal ini diketahui:
- n = 2
- T1 = 30 °C
- T2 = 70 °C
- t = 4 menit
- ΔT = 20 °C
Cara menjawab soal ini sebagai berikut:
→ t70 = (→ t70 = (
→ t70 = (
→ t70 =
Soal ini jawabannya B.
Contoh soal 5 (UN 2015)
Pada percobaan reaksi antara logam alumunium dan asam sulfat sesuai persamaan reaksi: 2 Al (s) + 3 H2SO2 (aq) → Al2(SO4)3 (aq) + 3H2 (g). Gas hidrogen ditampung dan diukur volumenya paa temperatur yang tetap. Data pengukuran tiap waktu sesuai tabel berikut:
| No | Waktu reaksi (detik) | Volume gas (mL) |
|---|---|---|
| 1 | 0 | 0 |
| 2 | 15 | 40 |
| 3 | 30 | 80 |
Laju reaksi pembentukan gas hidrogen setelah 30 detik adalah…
A. 0,83 mL/detik
B. 1,33 mL/detik
C. 2,67 mL/detik
D. 2,50 mL/detik
E. 7,50 mL/detik
Penyelesaian soal / pembahasan
Pada soal ini diketahui:
- t = 30 detik
- V = 80 mL
Cara menjawab soal ini sebagai berikut:
→ v =→ v =
Soal ini jawabannya C.
Contoh soal 6 (UN 2018)
Diketahui data percobaan reaksi 2A + B2 → 2 AB.

Grafik yang menunjukkan orde reaksi dari A adalah…
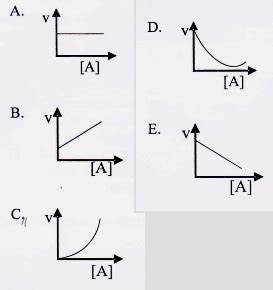
Penyelesaian soal / pembahasan
Cara menjawab soal ini sebagai berikut:
→→
→
→ n = 2
Jadi grafik yang sesuai adalah grafik kuadrat atau jawaban C.
Contoh soal 7
Dari percobaan pengukuran laju reaksi diperoleh data sebagai berikut.
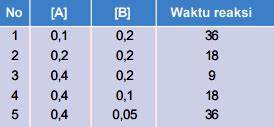
Dapat disimpulkan bahwa orde reaksi totalnya adalah…
A. 1
B. 2
C. 3
D. 4
E. 5
Penyelesaian soal / pembahasan
Hitung terlebih dahulu orde reaksi A dengan menggunakan data yang konsentrasi B sama yaitu data 1 dan 2.
→→
→
→ m = 1
Selanjutnya hitung orde reaksi B dengan menggunakan data yang konsentrasi A sama yaitu data 3 dan 4.
→→
→
→ n = 1
Jadi orde reaksi totalnya = m + n = 1 + 1 = 2. Soal ini jawabannya B.
Contoh soal 8
Data percobaan laju reaksi 2 NO (g) + 2 H2 (g) → N2 (g) + 2 H2O (g).
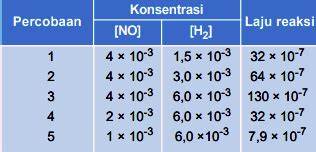
Berdasarkan data diatas, maka rumus laju reaksi yang benar adalah…
A. v = k [NO] [H2]
B. v = k [NO] [H2]2
C. v = k [NO]2 [H2]
D. v = k [NO]2
E. v = k [H2]2
Penyelesaian soal / pembahasan
Tentukan orde reaksi NO dengan menggunakan data 3 dan 4.
→→
→ 4 = 2m
→ m = 2
Selanjutnya menentukan orde reaksi H2 dengan menggunakan data 1 dan 2.
→→
→
→ n = 1
Jadi rumus laju reaksi v = k [NO]m [H2]n = k [NO]2 [H2]. Soal ini jawabannya C.