Contoh soal termokimia nomor 1
Jika diketahui kalor pembentukan H2 (g) + Cl2 (g) → 2HCl (g) adalah 185 kj, maka besar kalor penguraian HCl adalah …
A. +185 kj
B. -185 kj
C. -370 kj
D. +92,5 kj
E. -92,5 kj
Pembahasan
HCl (g) → 1/2 H2 (g) + 1/2 Cl2 (g)
Kalor penguraian = kebalikan dari kalor pembentukan. Jadi kalor penguraian HCL = 1/2 x – 185 kj = -92,5 kj. Soal ini jawabannya E.
Contoh soal termokimia nomor 2
Apabila 250 mL KOH 0,4 M dicampur dengan 250 mL larutan HCl 0,4 M, ternyata suhu naik dari 27 oC menjadi 35 oC dan berat jenis larutan 4,2 J/g.K, maka besarnya ΔH reaksi netralisasi tersebut adalah …
A. -168 kj
B. -16,8 kj
C. +16,8 kj
D. +168 kj
E. +1.680 kj
Pembahasan
- Massa campuran = 250 g + 250 g = 500 g
- qreaksi = – m . c . ΔT
- qreaksi = – 500 g . 4,2 J/g.K . (35 – 27) K
- qreaksi = -16.800 J
- mol KOH = mol HCl = 0,25 L . 0,4 = 0,1 mol
- ΔH =
= – 168.000 J
- ΔH = -168 kj
Soal ini jawabannya A.
Contoh soal termokimia nomor 3
Jika pada 50 mL larutan CuSO4 0,4 M ditambahkan serbuk zink berlebihan, maka suhu akan naik 20 oC. Dengan menganggap kalor jenis larutan sama dengan kalor jenis ai = 4,2 J/g.K dan kalor wadah reaksi diabaikan, maka besarnya ΔH untuk reaksi:
Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)
adalah …
A. 4.200 J
B. 21 kj
C. 42 kj
D. 16,8 kj
E. 210 kj
Pembahasan
- qreaksi = – m . c . ΔT
- qreaksi = – 50 gram . 4,2 J/g.K . 20 K
- qreaksi = – 4.200 J
- mol CuSO4 = M . V = 0,4 M . 0,05 L = 0,02 mol
- ΔH =
= -210.000 J
- ΔH = -210 kj
Soal ini jawabannya E.
Contoh soal termokimia nomor 4
Diketahui ΔHfo C2H2, CO2, dan H2O berturut-turut adalah -52 kj/mol, -394 kj/mol, dan -242 kj/mol. Besarnya kalor yang dihasilkan pada pembakaran 6,72 liter gas etuna pada keadaan standar sesuai reaksi:
2 C2H2 (g) + 5 O2 (g) → 4 CO2 (g) + 2 H2O (l)
adalah …
A. 6.024 kj
B. 2.112 kj
C. 2.008 kj
D. 602,4 kj
E. 586,8 kj
Pembahasan
- ΔHreaksi = ΣΔHfo (produk) – ΣΔHfo (reaktan)
- ΔHreaksi = 4 . ΔHfo CO2 + 2 ΔHfo H2O – (2 ΔHfo C2H2 + 5 ΔHfo O2)
- ΔHreaksi = 4 . (-394) + 2 . (-242) – (2 . (-52) + 5 . 0)
- ΔHreaksi = -1.576 – 484 + 104 = – 1.956 kj/mol
- mol C2H2 =
=
= 0,3 mol
- Kalor = mol . ΔHreaksi = 0,3 mol . (-1.956 kj/mol) = – 586,8 kj
Soal ini jawabannya E.
Contoh soal termokimia nomor 5
Diketahui kurva reaksi sebagai berikut.
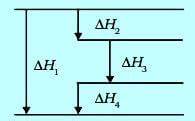
Berdasarkan kurva tersebut, harga ΔH2 adalah …
A. ΔH1 – ΔH2 – ΔH3
B. ΔH1 + ΔH2 – ΔH4
C. ΔH1 – ΔH3 – ΔH4
D. ΔH1 – ΔH3 + ΔH4
E. ΔH1 + ΔH3 + ΔH4
Pembahasan
- ΔH1 = ΔH2 + ΔH3 + ΔH4
- ΔH2 = ΔH1 – ΔH3 – ΔH4
Soal ini jawabannya C.
Contoh soal termokimia nomor 6
Diketahui:
CS2 (g) + 3O2 (g) → CO2 (g) + 2SO2 (g) ΔH = – 1110 kj
CO2 (g) → C (s) + O2 (g) ΔH = +394 kj
SO2 (g) → S (s) + O2 (g) ΔH = +297 kj
Maka perubahan entalpi pembentukan CS2 adalah …
A. +122 kj
B. -122 kj
C. +419 kj
D. -419 kj
E. +906 kj
Pembahasan
Reaksi (1) dan (2) dibalik, dan reaksi (3) dibalik dan dikali 2, hasilnya sebagai berikut.
- CO2 (g) + 2SO2 (g) → CS2 (g) + 3O2 (g) ΔH = + 1110 kj
- C (s) + O2 (g) → CO2 (g) ΔH = -394 kj
- 2S (s) + 2O2 (g) → 2SO2 (g) ΔH = -594 kj
- __________________________________________+
- 2S (s) + C (s) → CS2 (s) ΔH = +122 kj
Soal ini jawabannya A.
Contoh soal termokimia nomor 7
Diketahui persamaan termokimia sebagai berikut.
2NO (g) + O2 (g) → N2O4 (g) ΔH = a kj
NO (g) + 1/2 O2 (g) → NO2 (g) ΔH = b kj
Besarnya ΔH untuk reaksi 2 NO2 (g) → N2O4 (g) adalah …
A. (a + b) kj
B. (a + 2b) kj
C. (-a + 2b) kj
D. (a – 2b) kj
E. (2a + b) kj
Pembahasan
Reaksi (1) tetap sedangkan reaksi (2) dibalik dan dikali 2, hasilnya sebagai berikut.
- 2NO (g) + O2 (g) → N2O4 (g) ΔH = a kj
- 2NO2 (g) → 2NO (g) + O2 (g) ΔH = -2b kj
- ________________________________________+
- 2NO2 (g) → N2O4 (g) ΔH = (a – 2b) kj
Soal ini jawabannya D.
Contoh soal termokimia nomor 8
Jika diketahui perubahan entalpi untuk reaksi berikut.
2Fe (s) + 3/2 O2 (g) → Fe2O3 (s) ΔH = +822 kj/mol
C (s) + 1/2 O2 (g) → CO (g) ΔH = – 330 kj/mol
Perubahan entalpi untuk reaksi 3C (s) + Fe2O3 (s) → 2Fe (s) + 3CO (g) adalah …
A. -932 kj/mol
B. -712 kj/mol
C. -1812 kj/mol
D. +492 kj/mol
E. +712 kj/mol
Pembahasan
Reaksi (1) dibalik dan reaksi (2) dikali 3, hasilnya sebagai berikut.
- Fe2O3 (s) → 2Fe (s) + 3/2 O2 (g) ΔH = -822 kj/mol
- 3C (s) + 3/2 O2 (g) → 3CO (g) ΔH = – 990 kj/mol
- _______________________________________________+
- 3C (s) + Fe2O3 (s) → 2Fe (s) + 3 CO ΔH = -1.812 kj/mol
Soal ini jawabannya C.
Contoh soal termokimia nomor 9
Pembakaran gas propana mengikuti persamaan reaksi:
C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (g)
Jika ΔHfo C3H8 = – a kkal, ΔHfo CO2 = +b kkal, ΔHfo H2O = +c kkal, maka entalpi pembakaran propana ditentukan sebagai …
A. (b + c – a) kkal
B. (b + c + a) kkal
C. (3b + 4c – a) kkal
D. (3b + 4c + a) kkal
E. (-a – 3b – 4c) kkal
Pembahasan
- ΔHreaksi = ΣΔHfo (produk) – ΣΔHfo (reaktan)
- ΔHreaksi = 3 . ΔHfo CO2 + 4 ΔHfo H2O – (ΔHfo C3H8 + 5 ΔHfo O2)
- ΔHreaksi = 3 . (+b) + 4 . (+c) – ((-a) + 5 . 0) kkal
- ΔHreaksi = (3b + 4c + a) kkal
Soal ini jawabannya D.
Contoh soal termokimia nomor 10
Diketahui data energi ikatan:
H – H = 436,0 kj/mol
H – F = 567,0 kj/mol
F – F = 157,0 kj/mol
Kalor yang diperlukan untuk pembentukan 2 mol asam flourida adalah …
A. 52 kj
B. 26 kj
C. 13 kj
D. -105 kj
E. -541 kj
Pembahasan
- 1/2 H2 + 1/2 F2 → HF
- 1/2 H – H + 1/2 F – F → H – F
- H = 1/2 ((H – H) + (F – F)) – (H – F)
- ΔH = 1/2 (436,0 + 157,0) – (567,0)
- ΔH = 296,5 – 567 = – 270,5
- Kalor = mol x ΔH = 2 x (-270,5) = -541 kj
Soal ini jawabannya E.
Contoh soal termokimia nomor 11
Jika energi ikatan:
C = C = a kkal
C – C = b kkal
C – H = c kkal
H – H = d kkal
Untuk reaksi: C2H4 + H2 → C2H6
Nila perubahan entalpi reaksi akan sama dengan …
A. a + d – b – 2c
B. a + d – b + 2c
C. a + b – c + d
D. b + 2c – a + d
E. b + 2c – a – d
Pembahasan

- ΔH = 4 (C – H) + (C = C) + (H – H) → [6 (C – H) + (C – C)]
- ΔH = 4 (C – H) + (C = C) + (H – H) → [6 (C – H) + (C – C)]
- ΔH = 4c + a + d – [6c + b]
- ΔH = 4c + a + d – 6c – b
- ΔH = a + d – b – 2c
Soal ini jawabannya A.